支原体PCR检测试剂盒

项目背景
支原体(mycoplasma)是一类没有细胞壁、高度多形性、能通过滤菌器、可用人工培养基培养增殖的最小原核细胞型微生物,大小为0.1~0.3微米。由于能形成丝状与分枝形状,故称为支原体。其广泛存在于人和动物体内,且体积较小,很难通过普通光学显微镜观察到,普通抗生素对其也没有一个有效的抑制作用,因此支原体成为了细胞培养过程中常见而且难以检测清除的污染。
支原体污染对细胞会有多方面的影响,包括以下方面:1、细胞状态不佳,生长速度慢,实验无法推进;2、细胞内DNA、RNA及蛋白表达发生改变,影响实验结果;3、细胞对环境冲击耐受力降低;4、在细胞壁上附着支原体会改变细胞壁完整性。可以说对细胞及细胞相关实验有极其严重的影响,因此检测及清除广泛存在的支原体污染成为诸多实验室必须要经历的过程。
PCR Mycoplasma Test Kit可用于各种生物材料(如细胞培养物、实验动物分泌物、动物血清等) 支原体感染的检测。应用聚合酶链式反应技术(PCR)对支原体16s-rRNA基因保守区域的特异性片段进行扩增检测。该方法可以在数小时内得到结果,与传统的选择性培养基培养检测方法相比较,本方法更快速,灵敏度和特异性更高,不会出现由于培养法检测时大量培养支原体而可能带来的次级污染的问题。国内外研究表明,细胞培养的支原体污染中,有98%以上是由以下五种支原体引起的:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和无胆甾支原体(A.laidlawii),发酵支原体(M.Fermentans)。本试剂盒能检测包括以上五种常见支原体在内的40种支原体。
注:本试剂盒仅用于研究,不得用于诊断或临床实验。
试剂盒组成
Component | |
PCR Myco SuperMix | 500μL |
Primer Mix | 100μL |
Positive Control Template | 100μL |
6×Loading Buffer | 1mL |
使用说明书 | 1份 |
原理
PCR Mycoplasma Test Kit可用于各种生物材料(如细胞培养物、实验动物分泌物、动物血清等) 支原体感染的检测。应用聚合酶链式反应技术(PCR)对支原体16s-rRNA基因保守区域的特异性片段进行扩增检测。该方法可以在数小时内得到结果,与传统的选择性培养基培养检测方法相比较,本方法更快速,灵敏度和特异性更高,不会出现由于培养法检测时大量培养支原体而可能带来的次级污染的问题。国内外研究表明,细胞培养的支原体污染中,有98%以上是由以下五种支原体引起的:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和无胆甾支原体(A.laidlawii),发酵支原体(M.Fermentans)。本试剂盒能检测包括以上5种常见支原体在内的40种支原体。
使用方法
1 实验所需器材与试剂
1.1 器材
1)PCR仪
2)PCR反应管
3)电泳仪及水平电泳槽
4)高速离心机
5)微量移液器及移液器吸头
1.2 试剂
1)琼脂糖
2)EB(溴化乙锭)
3)去离子水或双蒸水
2 实验操作步骤
1. 样品制备
1.1贴壁细胞
待细胞生长至80%左右即可,取100μL细胞培养液至离心管,沸水浴10min。将煮沸过的细胞悬浮液12000rpm离心2-5min,取上清4μL作为PCR反应模板。
1.2悬浮细胞
细胞密度生长至106/mL左右即可,取100μL细胞培养液至离心管,沸水浴10min。将煮沸过的细胞悬浮液12000rpm离心2-5min,取上清4μL作为PCR反应模板。
1.3血清
用无菌水将血清稀释20倍,取100μL至离心管,沸水浴10min。取4μL作为PCR反应模板。
2. PCR
穿戴好干净的口罩和手套,在超净台中参照下表配制反应混合液, 设置阴性对照(无菌水)与阳性对照(Positive Control Template),严格遵循无菌操作,避免外源支原体污染。
PCR体系(25μL体系)
Component | 阳性 | 阴性 | 待检样品 |
PCR Myco SuperMix | 5μL | 5μL | 5μL |
Primer Mix | 1μL | 1μL | 1μL |
Positive Control Template | 1μL | 0μL | 0μL |
样品 | 0μL | 0μL | 4μL |
无菌水(需自备) | 18μL | 19μL | 15μL |
3. 将所有PCR反应管放入PCR仪,参照以下参数运行PCR仪。
预变性 94℃ for 5min
循环 94℃ for 30sec
56℃ for 30sec 30cycles
72℃ for 45sec
延伸 72℃ for 5min
4. PCR完成后,在PCR产物中添加6×loading buffer,取3μL在1%琼脂糖凝胶上直接点样,120V电泳20min。(可根据电泳仪的情况,适当调整参数)
5. 通过与阳性对照、阴性对照电泳结果比较,确认样品是否有支原体污染,阳性条带大小约为250bp。
注:如阴性对照出现条带,则有可能是体系污染,建议重新检测确认结果。
电泳图参考如下:
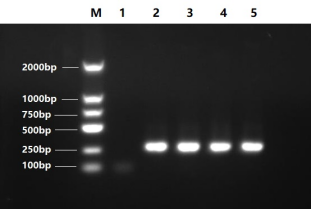
M:2000bp DNA Marker
1: negative control
2-5:positive control(4 different cell samples)
6. 推荐使用频率:
新细胞进入实验室 必检
液氮冻存前 必检
定期常规 每月检测一次
发现污染后 每周检测一次
发现细胞异常 随时检测
【注意事项】
l 使用本试剂前请仔细阅读本说明书全文。
l 操作时应尽量少说话,因口腔中也含有支原体,可能引起样品污染,而造成假阳性;整个检测过程中,反应体系的配制、样本处理及加样、PCR扩增应分区域进行,以避免交叉污染。
l 实验时,试剂盒组分中的试剂使用前应充分融化并混匀(混匀时禁止激烈振荡,只需要进行上下倒置多次进行混匀)。
l 反应管中加好所有的试剂后,应尽快上PCR仪进行扩增,以免形成过多的二聚体。
l 细胞培养物中含有青霉素和链霉素等抗生物素不会影响本品的检测结果。如果用户需要进一步提高检灵敏度,建议细胞在不含青霉素和链霉链等抗生素中进行培养2-3天后送样检测。
l 本试剂盒仅用于研究,不得用于诊断或临床实验。
—— 仅供科研参考使用 ——
